|
Cato Maximilian Guldberg
(1836–1902)
és
Peter Waage
(1833–1900)
Affinitási vizsgálatok
Forhandlinger: Videnskabs-Selskabet i Christiana 1864, 35.
(A ChemTeam gyûjteményében megjelent fordítás alapján)
 |
Guldberg és Waage 1864 és 1867 között több cikkben is megfogalmazta és alátámasztotta a tömeghatás törvényét. Dolgozataik nem váltak olyan ismertté, mint szerették volna, és más szerzôk, például Ostwald és van't Hoff a törvény speciális eseteire vezettek le összefüggéseket anélkül, hogy ismerték volna az eredeti munkát. Guldberg és Waage 1879-ben újra összefoglalta korábbi eredményeit, és elemezte, hogy más szerzôk vizsgálatai milyen bizonyítékokat szolgáltattak az elmélet helyessége mellett. A tömeghatás törvénye végül is Guldberg és Waage nevével került be a tankönyvekbe. |
A kémiai erôk hatásának módjára vonatkozó eddigi elméleteket, akár elektrokémiai, akár termokémiai elméletekrôl legyen is szó, a vegyészek nem tartják kielégítônek. Kétségesnek kell tekintenünk, hogy az elektromos változások és a kémiai folyamatokat kísérô hôfejlôdés segítségével megtalálhatók-e valaha is a kémiai erôk mûködését leíró törvények.
A kémiai erôhatások módjának meghatározására ezért célravezetôbb eljárást kerestünk. Úgy gondoljuk, hogy a különbözô anyagok közötti kölcsönhatások kvantitatív vizsgálatával olyan utat nyitottunk, amely igen biztonságos és természetes módon vezet el a célhoz. Emlékeztetnünk kell arra, hogy Berthelot és S. Gilles urak 1862 nyarán közzétett dolgozata, amely az észteresítést tárgyalta, jelentôs mértékben hozzájárult módszerünk kiválasztásához.
1862 ôszén megkezdett munkánk 300 kvantitatív vizsgálatra terjedt ki. Eredményeink nyomán határozott képet alkottunk a kémiai folyamatokról, új elméletet dolgoztunk ki és törvényeket állapítottunk meg, amelyeket röviden ismertetünk, és részben magunk, részben más vegyészek kísérleteivel támasztunk alá.
A vegyületek – mint ismeretes – két típusba sorolhatók:
1) tökéletes vegyületek, amelyek az atomokat mindig határozott arányok szerint tartalmazzák, és
2) nem tökéletes vegyületek, amelyek összetétele, bizonyos határok között, rendszertelenül változik.
Az elsô típusba azok tartoznak, amelyeket – általános felfogás szerint – kémiai vegyületeknek nevezünk. Ezek összetétele mindig leírható a három fô típus valamelyikével
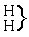
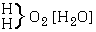
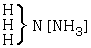
[Az elsô képlet kapcsos zárójel utáni vegyjele valószínûleg lemaradt az eredeti cikkben.]
vagy ezek többszöröseivel vagy kombinációival.
A második csoportba soroljuk az ötvözeteket, az oldott anyagból és az oldószerbôl kialakuló vegyületeket, az egyes kovasav- és bórsav-vegyületeket stb.
A nem tökéletes vegyületek olyan erôk hatására jönnek létre, amelyek kétségtelenül kicsik a tökéletes kémiai vegyületek keletkezésekor és bomlásakor szerepet játszó erôkhöz képest.
A jelen dolgozatban csak azokat a kémiai folyamatokat1 vizsgáljuk, amelyekben tökéletes kémiai vegyületek vesznek részt. Ezek a folyamatok a következô módon csoportosíthatók:
(A) Egyszerû folyamatok,
amelyek mindig besorolhatók a következô két csoport egyikébe:
(a) két molekula közvetlen egyesülése új molekulává (addíció) és ennek ellenkezôje, egy molekula felhasadása két másikká,
(b) két molekula alkotórészeinek kölcsönös cseréje vagy szubsztitúciója és ennek ellenkezôje, az eredeti molekula visszaállítása fordított szubsztitúcióval. Az egyik folyamatot akciónak, a másikat reakciónak nevezhetjük.
(B) Összetett folyamatok,
amelyek mindig több egyszerû folyamat sorozatának tekinthetôk.
Az addíciós és hasadási folyamatok példájaként elegendô az ammónium-klorid képzôdésére és bomlására utalnunk: a sósavból és ammóniából képzôdô vegyület sósavra és ammóniára hasad. A szervetlen és szerves kémiában mindennél gyakoribb a kölcsönös szubsztitúció. Igen sokszor lejátszódik például két különbözô só találkozásakor, ha az eredeti és az újonnan képzôdô sók oldhatók, de akkor is, ha az egyik só – a folyamat elôtt vagy után – oldhatatlan. Az összetett kémiai folyamatokra igen gyakori példa a bázikus sók képzôdése, amikor az elôbb idézett mindkét egyszerû folyamat egyszerre játszódik le. Ha a
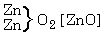
a
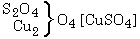
oldatára hat, a sókból részben
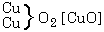
részben
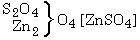
keletkezik. A képzôdött réz-oxid és a még változatlan cink-oxid addícióban vesz részt; az elôbbi a változatlan réz-szulfáttal, az utóbbi a képzôdött cink-szulfáttal, és a két folyamat eredményeként két bázikus só keletkezik. A fentiekben hangsúlyoztuk, hogy mindkét egyszerû kémiai folyamatban két erô hat, egy egyesítô és egy bontó, vagy egy ható és egy visszaható erô. Ha az erôk bármilyen kvantitatív leírására törekszünk, ezeket az erôket feltétlenül együtt kell tekintenünk.
A kémiában igen gyakran tapasztaljuk, hogy ez a két ellentétes erô egyszerre lép fel ugyanabban a kémiai folyamatban. Elegendô csupán a kén-hidrogén és a fémsó-oldatok közötti folyamat, illetve a savak és a fém-szulfidok közötti ellentétes folyamat kapcsolatára utalnunk. Példaként hozható fel az alkáli-vegyületek és az oltott mész jól ismert egymásra hatása. Attól függôen, hogy híg vagy tömény, meleg vagy hideg oldatokat használunk, a folyamatot tetszés szerint rábírhatjuk arra, hogy a két ellentétes irány bármelyikében lejátszódjék. Ha megfelelô hômérsékletû és koncentrációjú oldatokkal dolgozunk, tökéletesen azonos körülmények között az akció és a reakció is lejátszódhat attól függôen, hogy egyik vagy másik vegyületpárból indultunk-e ki.
Gyakran úgy tûnik, hogy a folyamatok csak az egyik vagy a másik irányban játszódnak le a kémiában; ilyenkor többnyire az egyesítô erô vagy nagyon nagy, vagy nagyon kicsi az ellentétes erôhöz képest az aktuális körülmények között. Ha módosítjuk azokat a körülményeket, amelyekben az erôk egyik vagy másik irányban hatnak, akkor az ellentétes irányú erô körülbelül olyan hatást fejthet majd ki, mint az elôzô erô – és ebben az esetben a folyamat egyszerre mindkét irányban lejátszódik –, vagy az ellentétes irányú erô válik dominánssá, és csak a folyamat második része válik érzékelhetôvé. Példaként idézzük számos fém oxidációját vízben alacsonyabb vagy magasabb hômérsékleten és – ennek ellenkezôjét – a fém-oxidok redukcióját hidrogénnel, vagy Pebal kísérletét az ammónium-klorid képzôdésével és magas hômérsékletû bomlásával kapcsolatban [Annalen der Chemie und Ph[arm]. 123, p. 199 (1862)]. Újabb példa a higany oxidációja kb. 300 oC-on és az oxid bomlása a vörös izzás hômérsékletén. Tehát a 300o és a vörös izzás közötti hômérséklet-tartományban az oxid részben elbomlik és a fém részben oxidálódik.
Az a jól ismert jelenség, hogy a nehezen oldódó sókat gyakran könnyebb egy másik só oldatában feloldani, mint vízben, szintén természetes magyarázatot nyer a részleges szubsztitúcióval.
A kémiai erôk nagyságának meghatározásához mindig szükségesnek tartjuk, hogy a kémiai folyamatokat olyan körülmények között tanulmányozzuk, hogy a két ellentétes irányban egyszerre végbemehessenek. Ha ilyen körülmények között megtaláltuk a különbözô anyagok esetében ható erôk nagyságát leíró kvantitatív kifejezést, utána meg kell találnunk, hogy a külsô körülmények (pl. a hômérséklet és az oldhatóság) milyen törvények szerint módosítják ezeket az erôket, és csak ekkor tudjuk majd elôre kiszámítani a kémiai erôk hatásának eredményét tetszôleges körülmények és anyagok esetén.
Ha fenntartjuk, hogy egy adott kémiai folyamatban két ellentétes erô hat, és az egyik az új anyagok keletkezését, a másik az eredeti vegyületek visszaalakulását segíti elô, nyilvánvaló, hogy amikor a kémiai folyamatban ezek az erôk azonos nagyságúak lesznek, a rendszer egyensúlyba jut. Az már az anyag természetébôl következik, hogy azonos körülmények között azonos egyensúly áll be, akármelyik oldalról közelítjük is meg.
Miután vázoltuk, hogy felfogásunk szerint hogyan kell értelmezni a kémiai folyamatokat, megállapítjuk azokat a törvényeket, amelyek szerint az egyszerû kémiai folyamatok második csoportjára, a szubsztitúciós folyamatokra hatnak a kémiai erôk.
Részben más szerzôk korábbi kísérletei, részben saját kísérleteink alapján, a kémiai folyamatok fent kifejtett lefolyását szem elôtt tartva megfogalmazzuk a következô két törvényt, nevezetesen a tömeghatás törvényét és a térfogathatás törvényét, amelyekbôl levezetjük a rendszerben ható erôkre vonatkozó egyensúlyi feltételt.
(1) A tömeghatás
A szubsztitúciós erô, azonos körülmények között, egyenesen arányos a megfelelô hatványra emelt tömegek szorzatával.
Ha az egymásra ható két anyag mennyiségeit M-mel és N-nel jelöljük, akkor ezek szubsztitúciós ereje:
a·(MaNb)
Az a, a és b együttható konstans, amely azonos körülmények között csak az anyagi minôségtôl függ.
(2) A térfogathatás
Ha a kölcsönható anyagok azonos tömegei különbözô térfogatokat foglalnak el, akkor ezeknek a tömegeknek a hatása fordítottan arányos a térfogattal.
Ha – a fentiekhez hasonlóan – M és N jelöli a két anyag tömegét, V és V* pedig a rendszer össztérfogatát két különbözô esetben, akkor a szubsztitúciós erô az egyik esetben a·(M/V)a(N/V)b, a másikban a·(M/V*)a(N/V*)b.
(3) Az egyensúlyi egyenlet
Ha az általános rendszerbôl indulunk ki, ahol a négy reagáló anyag különbözô kapcsolatban állhat egymással, és ezeknek az anyagoknak a mennyiségét – ugyanarra a térfogatva vonatkoztatva – az elsô törvény szerint p, q, p', q'-veljelöljük, akkor az egyensúlyi állapot eléréséig az elsô két anyagból egy bizonyos x mennyiség alakul át. Az egymással egyensúlyt tartó mennyiségek tehát p - x, q - x és p' + x, q' + x. A tömeghatás törvénye szerint az elsô két anyag ható ereje a·(p - x)a(q - x)b, a második kettô visszaható ereje a'·(p' + x)a'(q' + x)b'. Innen az egyensúly
| a·(p - x)a(q - x)b = a'·(p' + x)a'(q' + x)b' |
I. |
Ebbôl x meghatározható, tehát minden rendszer esetén kiszámítható az adott anyagok mennyiségének változása. Látható, hogy az egyenlet hat együtthatója közül csak négy független. Ezeket kísérlettel kell meghatározni, mint ahogy a különbözô anyagmennyiségekhez tartozó, változó x mennyiséget is meg kell határozni az egyensúly elérése után.
Egyenletünkkel könnyen magyarázható az a gyakori jelenség, hogy egy kémiai folyamatot csak egyetlen irányban látunk lejátszódni. Mivel a ható erôk nem arányosan, hanem hatvány szerint nônek a tömegek függvényében, a hatványok arányának nem is kell különösebben nagynak lennie, hogy a változatlan vagy változó mennyiség olyan kicsivé váljék, amilyen szokásos analitikai módszereinkkel már nem mutatható ki. Az egyik kísérletsorozatban például ..., ha a hatványok aránya 1:150-et ért el, a megváltozott mennyiség mindössze 1/1000% volt; ebben az esetben a kísérlet természetesen azt mutatta, hogy nem zajlik le változás.
A megváltozott x mennyiség általában nem határozható meg egyetlen kísérletbôl. A matematika nyelvén ez azt jelenti, hogy az egyensúlyi állapot rendszerint csak akkor érhetô el, ha a kölcsönhatás végtelenül hosszú ideig tart. Közben, ha a kölcsönhatás különbözô idôpontjaiban ugyanazokra a tömegekre meghatározzuk a megváltozott mennyiséget, láthatjuk, hogy milyen határérték felé közeledik. Ha a kísérletet úgy végezzük, hogy a határértéket a két ellentétes oldal felôl közelítjük meg, például nemcsak p, q, hanem p', q' vegyületeket is használunk kiindulásként, még pontosabb eredményt kapunk. Emiatt a körülmény miatt a folyamatok különbözô fázisaiban nagyszámú hatérték-meghatározást kellett végeznünk, de így sincs birtokunkban elegendô anyag ahhoz, hogy megtaláljuk a folyamatok sebességét leíró törvényt. Számos kísérletben vizsgáltuk, hogy a hômérséklet miként befolyásolja az egyensúlyi állapotot. A kísérletek most is folynak; eredményeinket késôbb kívánjuk nyilvánosságra hozni.
A fent megállapított törvényeket három kísérletsorozattal támasztjuk alá.
I. Etil-alkohol, ecetsav, etil-acetát és víz kölcsönhatása
(Berthelot és St. Gilles 1862-es kísérletei)
Mintegy 500 kísérletbôl álló sorozatukban a szerzôk az alkoholok és számos szerves sav kölcsönhatását és ennek megfelelôen az észterek víz hatására bekövetkezô bomlását tanulmányozták. Tapasztalataik szerint ezeknek a szerves vegyületeknek az esetében a folyamat viszonylag lassan zajlik, s így az egyensúlyi állapot csak végtelenül hosszú idô után érhetô el. Megállapították, hogy különbözô egyensúlyi állapotok állnak elô, ha a négy anyag különbözô mennyiségei lépnek egymással kölcsönhatásba. Kifejezetten rámutattak azonban arra, hogy ezeket a jelenségeket csak a szerves vegyületekhez rendelik, és éles különbséget látnak az észterek, illetve a szervetlen vegyületek és szervetlen sók között. A fentiekbôl és a szervetlen kémiai vizsgálatokból remélhetôleg kiderül, hogy a jelenséget minden egyszerû kémiai folyamatra jellemzônek tartjuk, akár szerves, akár szervetlen kémiai átalakulásokról legyen is szó.
A szerzôk semmilyen törvényt nem állítottak fel a tömeghatásra kísérleteik alapján.
Legteljesebb kísérletsorozatukra, az etil-alkohollal és ecetsavval végzett vizsgálatokra alkalmaztuk általános kifejezéseinket. A számított és a mért értékek egyezése igen kielégítô; ... p = ecetsav, q = alkohol, p' = etil-acetát, q' = víz. Az együtthatók: a = 1, b = 0,786, a' = 0,846, b' = 0,807, a'/a= 0,502, térfogat = 10000.
II.
A második kísérletsorozatot a következô anyagokkal végeztük:
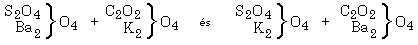
[BaSO4 + K2CO3 és BaCO3 + K2SO4]
H. Rose már publikálta a Pogg's Annals [Poggendorff's Annalen der Physik und Chemie] 1855-ös évfolyamában a kálium-karbonát és a bárium-szulfát különbözô hômérsékleteken zajló kölcsönhatásainak vizsgálatát, és kimutatta, hogy ezek az anyagok részleges konverzióban vesznek részt, amely a kálium-karbonát mennyiségének növelésével egyre teljesebb lesz. Bár azt is észlelte, hogy a folyamat azonos körülmények között az ellentétes irányban is lezajlik, sem az idô hatását nem vizsgálta, sem az egyensúlyi állapot létrejöttét nem mutatta ki ...
... [A harmadik kísérletsorozatban a kovasav és nátrium-karbonát reakcióját vizsgálják a szerzôk.] ...
Összegzésképpen röviden összehasonlítjuk elméletünket a kémiai erôkre vonatkozó korábbi véleményekkel.
A kémiai affinitásra elôször a svéd Bergman dolgozott ki elméletet 1780-ban, még az atomelmélet megjelenése elôtt. Bergman felteszi, hogy minden anyag adott affinitást mutat minden más anyaggal szemben, s ennek nagysága független az anyag tömegétôl. Bár ez a felfogás egyes esetekben helyesnek tûnhet, számos kémiai folyamat cáfolja, és elméletünkkel is teljes ellentmondásban van.
Berthollet 1801–1803-ban állapította meg, hogy az anyagok affinitásai azon kívül, hogy függenek az anyagi minôségtôl, szintén módosulnak – és ez a fontos – az anyagok eredeti mennyiségének és az anyagok fizikai tulajdonságainak, például az illékonyságnak vagy az oldhatatlanságnak a függvényében.
Látható, hogy elméletünkbe beillesztettük Berthollet elméletének azt a részét, hogy egy kémiai folyamatban a kémiai erôk függenek a tömegektôl. Másrészt Berthollet tömeghatás törvényét, amely szerint az affinitás mindig arányos a tömeggel, kísérleteink igen határozottan cáfolják. Kísérleteink továbbá arra utalnak, hogy a kémiai folyamatokban részt vevô, oldhatatlan és illékony anyagok inaktivitására vonatkozó Berthollet-felfogás helytelen. Erre Berthelot is rámutatott a szerves anyagok tárgyalásakor.*
Valaki már korábban is megpróbálta egyfajta kémiai folyamatra alkalmazni az összes kémiai folyamat egyensúlyi állapotára kidolgozott, de kvantitatíve nem bizonyított elméletünket. Ez a folyamat két különbözô, oldható só keveredése, amelynek során nem képzôdik csapadék. Részben bizonyos színreakciókkal, részben a polarizált fény síkjának elforgatásából (Gladstone), részben diffúziós kísérletekkel (Graham és Gladstone) próbálták bizonyítani, hogy az oldható sók részleges szubsztitúciója lejátszódik.
Berthelot és St. Gilles észterezési, valmint Rose bárium-szulfáttal és kálium-karbonáttal végzett vizsgálatait az I. és a II. kísérletsorozat ismertetésekor vetettük össze elméletünkkel.
1. Minden olyan jelenséget kémiai folyamatnak tekintünk, amelyben a kémiai erôk kémiai változást idéznek elô az anyagban.
* Berthollet az oldatokat és a vegyületeket nem különböztette meg, ezért úgy gondolta, hogy az anyagok relatív mennyisége nemcsak a reakció irányát, hanem a termékek összetételét is befolyásolja. (Szerk.) | |
|
Segíts te is! ide írj puskákat! |
|
| | |
|
|

